MODUL AJAR KIMIA ASAM BASA
MODUL AJAR
KIMIA ASAM BASA
PENDAHULUAN
A. Identitas Modul
Mata Pelajaran : Kimia
Kelas : XI
Alokasi Waktu :16 Jam Pelajaran
Judul Modul :Larutan Asam dan Basa
B. Kompetensi Dasar
3.10 Menjelaskan konsep asam dan basa serta kekuatannya dan kesetimbangan pengionannya dalam larutan.
4.10 Menganalisi trayek perubahan pH beberapa indikator yang diektrak dari bahan alam melalui percobaan
C. Deskripsi Singkat Materi
Pengetahuan tentang larutan asam basa merupakan prasarat untuk mempelajari
pokok bahasan lain yaitu titrasi, larutan penyangga dan hidrolisis garam. Pengetahuan
ini sangat bermanfaat agar kita lebih bijak dalam memanfaatkan bahan-bahan kimia
dengan meminimalisasi efek samping atau bahayanya.
Modul ini memaparkan beberapa teori asam basa menurut beberapa ahli dengan
sudut pandang yang berbeda. Teori asam basa yang dibahas meliputi teori Arrhenius,
Teori Bronsted-Lowry dan teori Lewis.
Selanjutnya secara khusus membahas larutan asam basa dengan air sebagai
pelarutnya. Sebagai dasar akan dijelaskan sistem kesetimbangan air murni, kemudian
pengaruh penambahan zat asam atau pengaruh penambahan zat basa. Penambahan
tersebut menyebabkan larutan bersifat asam atau basa, dengan kekuatan asam basa
yang bergantung pada perbandingan lebih banyak atau sedikitnya konsentrasi ion H+
atau OH-
. Terdapat beberapa rumus untuk menghitung konsentrasi ion H+ atau OHuntuk asam kuat, asam lemah, basa kuat ataupun basa lemah.
Kekuatan asam basa juga dinyatakan dalam bentuk lain yaitu nilai derajat keasaman
atau pH. Nilai pH antara 1 sampai 14 dengan penjelasan sifat dari asam, netral sampai
basa.
Identifikasi larutan asam basa dapat dilakukan dengan penambahan indikator asam
basa baik dari bahan alami atau sistesis dari laboratorium.
D. Petunjuk Penggunaan Modul
Agar proses belajar lebih efektif dan bisa mendapatkan hasil belajar sesuai dengan tujuan pembelajaran, maka berikut diberikan petunjuk penggunaan modul.
- Sebelum mempelajari materi tentang larutan asam, kalian harus menguasai dahulu konsep larutan elektrolit dan kesetimbangan kimia.
- Perhatikan tujuan pembelajaran agar apa yang kita pelajari menjadi lebih fokus.
- Pelajari kegiatan belajar sesuai urutan dalam modul, dengan mengembangkan rasa ingin tahu, berpikir kritis dan kreatif.
- Kerjakan tugas mandiri dengan sungguh-sungguh dan bertanggung jawab untuk melatih ketrampilan berpikir.
- Isilah tabel penilaian diri dengan jujur agar benar-benar dapat mengukur ketercapaian kalian dalam belajar.
E. Materi Pembelajaran
Modul ini terbagi menjadi 4 kegiatan pembelajaran dan di dalamnya terdapat uraian
materi, penugasan mandiri, contoh soal, soal latihan dan soal evaluasi.
Pertama : Teori Asam Basa
Kedua : Kesetimbangan Ion dalam Larutan
Ketiga : Derajat Keasaman
Keempat : Indikator Asam Basa
KEGIATAN PEMBELAJARAN 1
TEORI ASAM DAN BASA
A. Tujuan Pembelajaran
Setelah kegiatan pembelajaran 1 ini kalian diharapkan dapat menjelaskan sifat asam
basa senyawa menurut teori asam basa.
B. Uraian Materi
Senyawa asam dan basa sudah banyak dikenal oleh masyarakat. Berbagai
kebutuhan kalian mulai dari makanan, minuman, obat-obatan serta keperluan
kebersihan semuanya dapat tergolong dalam senyawa asam atau basa. Kalian mungkin
dengan gampang bisa menentukan sifat larutan dari rasa. Secara umum yang berasa
masam tergolong senyawa asam dan yang getir adalah tergolong senyawa basa.
Teori Asam Basa
1. Teori Asam Basa Arrhenius
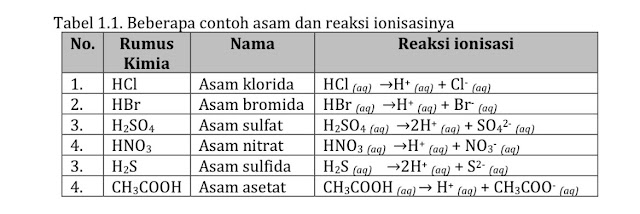
Menurut Arrhenius Asam adalah zat yang jika dimasukkan dalam air zat tersebut
dapat menghasilkan ion hydronium (H+). Senyawa asam pada umumnya
merupakan senyawa kovalen polar yang terlarut dalam air.
Berikut adalah contoh senyawa yang termasuk asam dan reaksi ionisasinya dalam air.
Menurut Arrhenius basa adalah zat yang jika dimasukkan dalam air, zat tersebut dapat menghasilkan ion hidroksida (OH-).
2. Teori Asam Basa Bronsted-Lowry
Teori asam basa Arrhenius tidak bisa menjelaskan sifat asam basa pada
larutan yang tidak mengandung air. Kelemahan ini diatasi menggunakan teori
asam basa bronsted-lowry. Teori ini bisa menjelaskan sifat asam basa larutan
dengan jenis pelarut yang bermacam-macam.
Bronsted-lowry menjelaskan basa adalah spesi (ion atau molekul) yang dapat
memberikan ion H+ (donor proton), sedangkan basa adalah spsesi yang dapat
menerima ion H+(akseptor proton).
Asam = donor H+
Basa = akseptor H+
Sebagai contoh, HCl bersifat asam karena memberikan ion H+ pada molekul H2O, kemudian H2O
bersifat basa karena menerima ion H+ dari HCl.
Cl- adalah basa konjugasi dari HCl.
Asam dan basa konjugasi atau basa dan asam konjugasi disebut sebagai
pasangan asam basa konjugasi. Garis hubung berikut menunjukkan pasangan
asam basa konjugasi.
3. Teori Asam Basa Lewis
G. N. Lewis mengemukakan teori asam basa yang lebih
luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan
elektron yang berkaitan dengan struktur dan ikatan. Menurut definisi asam basa
Lewis asam adalah akseptor pasangan elektron, sedangkan basa adalah donor
pasangan elektron.
Asam = akseptor pasangan elektron
Basa = donor pasangan elektron
Sebagai contoh, reaksi antara BF3 dan NH3 merupakan reaksi asam–basa, di
mana BF3 sebagai asam Lewis dan NH3 sebagai basa Lewis. NH3 memberikan
pasangan elektron kepada BF3 sehingga membentuk ikatan kovalen koordinasi
antara keduanya.
Kelebihan definisi asam basa Lewis adalah dapat menjelaskan reaksi-reaksi
asam–basa lain dalam fase padat, gas, dan medium pelarut selain air yang tidak
melibatkan transfer proton.
C. Rangkuman
- Teori asam basa Arrhenius menjelaskan bahwa asam adalah senyawa yang di dalam air dapat melepaskan ion H+ sedangkan basa adalah senyawa yang di dalam air dapat menghasilkan ion OH- . Teori ini hanya terbatas untuk larutan dengan pelarut berupa air.
- Teori asam basa Bronsted-Lowry menjelaskan bahwa asam adalah spesi yang memberikan proton (donor H+) sedangkan basa adalah spesi yang menerima proton (akseptor H+). Teori ini dapat menjelaskan sifat asam basa suatu larutan meskipun pelarutnya bukan air.
- Teori asam basa Lewis menjelaskan bahwa asam adalah spesi penerima pasangan elektron, sedangkan basa adalah spesi yang memberikan pasangan elektron.
Pilihlah salah satu jawaban yang paling tepat!
1. Menurut Teori asam basa Arrhenius, zat dikatakan asam jika...
A. Dalam air menghasilkan ion H+
B. Dalam air menghasilkan atom H
C. Donor proton
D. Akseptor proton
E. Donor pasangan elektron
2. Diantara larutan-larutan berikut, larutan manakah yang merupakan larutan basa?
A. C2H5OH
B. CH3COOH
C. HCl
D. NaOH
E. NaCl
3. Dalam reaksi:
NH4
+
(aq) + H2O(l) NH3(aq) + H3O+
(aq)
Pasangan asam basa konjugasi adalah...
A. NH4
+
(aq) dengan H2O(l)
B. NH3(aq) dengan NH4
+
(aq)
C. NH4
+
(aq) dengan H3O+
(aq)
D. NH3(aq) dengan H3O+
(aq)
E. NH3(aq) dengan H2O(l)
4. Menurut teori asam basa Lewis, sifat H2O dalam reaksi H2O+ CO2 → H2CO3.
A. Asam
B. Basa
C. Asam konjugasi
D. Basa Konjugasi
E. Netral
5. Diantara spesi berikut manakah yang tidak berlaku sebagai asam Bronsted-Lowry
…
A. NH4+
B. H2O
C. HCO3
–
D. CO3
2-
E. H2CO3
E. Penilaian Diri
Selanjutnya kalian harus mengisi lembar penilaian diri untuk mengukur tingkat
keberhasilan diri kalian dalam penguasaan materi tentang teori asam basa.
- Dapatkah kalian menjelaskan teori asam basa Arrhenius? (YA/TIDAK)
- Dapatkah kalian menjelaskan sifat suatu larutan berdasarkan teori asam basa Arrhenius? (YA/TIDAK)
- Dapatkah kalian menjelaskan teori asam basa Bronsted-Lowry? (YA/TIDAK)
- Dapatkah kalian menjelaskan sifat suatu larutan berdasarkan teori asam basa Bronsted-Lowry? (YA/TIDAK)
- Dapatkah kalian menjelaskan teori asam basa Lewis? (YA/TIDAK)
- Dapatkah kalian menjelaskan sifat suatu larutan berdasarkan teori asam basa Lewis? (YA/TIDAK)
Jika menjawab “Tidak” pada salah satu pertanyaan di atas, maka pelajarilah kembali
materi tersebut sehingga kalian betul-betul dapat menguasai materi. Jangan putus asa
untuk mengulang lagi!. Dan apabila kalian menjawab “Ya” pada semua pertanyaan,
maka lanjutkan mengerjakan kegiatan belajar selanjutnya.

Comments
Post a Comment